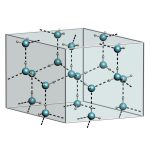
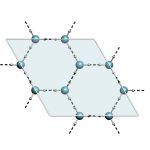
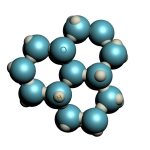
¿Cómo se organizan las moléculas de un material molecular en estado sólido? La respuesta es previsible, pues, en general, adoptan un ordenamiento cristalino.
El agua puede servirnos de ejemplo. En el agua las fuerzas secundarias entre moléculas son originadas por la gran diferencia de electronegatividad entre el oxígeno y el hidrógeno. Cuando un átomo de hidrógeno se une a un átomo mucho más electronegativo que él (como el oxígeno, el flúor o el nitrógeno), el par de electrones que forman el enlace se desplaza hacia el átomo con mayor electronegatividad.
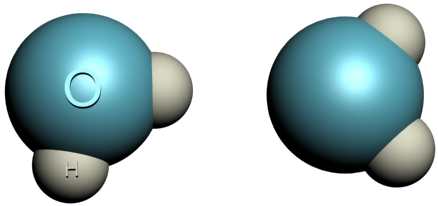
El resultado es la aparición de una carga parcial positiva sobre el átomo de hidrógeno y una carga parcial negativa sobre el otro átomo. En virtud de estas cargas se establece una atracción electrostática entre los hidrógenos de una molécula y los oxígenos, en el caso del agua, de la molécula vecina. En esta situación específica, las fuerzas secundarias suelen denominarse puentes de hidrógeno.