En la estructura cúbica centrada en las caras, los átomos están situados en los vértices de la celdilla unidad y en el centro de sus caras, o sea, en las posiciones de los nudos de la red de Bravais del mismo nombre.
Las características más importantes de este tipo de estructura pueden resumirse en:
El número de átomos que contiene la celdilla unidad es de 4: \(\frac{1}{2}6\) átomos (en el centro de las caras) y \(\frac{1}{8}8\) átomos (en los vértices).
El número de coordinación de la estructura CCC es 12. La forma más sencilla de efectuar este recuento es situándose mentalmente en el átomo del centro de una de las caras (de color rojo en la siguiente figura), y contar todos los átomos en contacto con él (los coloreados en azul).
– Direcciones de mayor concentración atómica
Los átomos están en contacto a lo largo de las diagonales de la cara, o sea, a lo largo de las direcciones \(\left \langle 110 \right \rangle\). Así pues, \(\sqrt{2a}=4r\) , de donde, \(a=2\sqrt{2r}\).
Puede comprobar fácilmente que la fracción de empaquetamiento es del 74%. Este valor representa una cota máxima para la fracción de empaquetamiento en las estructuras en las que sólo intervienen átomos idénticos
– Planos de mayor concentración atómica (compacidad)
Las estructuras que poseen el valor máximo de la fracción de empaquetamiento, 74%, se dice que son estructuras de máxima fracción de empaquetamiento, o de máxima compacidad. Como consecuencia de ello, en la estructura CCC pueden encontrarse planos atómicos con la mayor concentración atómica posible. Estos planos son los \(\left \{ 111 \right \}\).
Planos {111} en la estructura CCC.
La siguiente tabla resume el cálculo de la concentración atómica superficial de los planos \(\left \{ 100 \right \}\), \(\left \{ 110 \right \}\) y \(\left \{ 111 \right \}\), en la estructura CCC.
| Planos | Sección planar considerada |
Número de átomos contenidos en la sección considerada | Área de la sección planar considerada | Concentración atómica superficial |
| $$\left \{ 100 \right \}$$ | 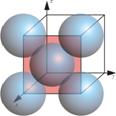 |
$$1+4\frac{1}{4}=2$$ | $$a^{2}$$ | $$\frac{2}{a^{2}}$$ |
| $$\left \{ 110 \right \}$$ | 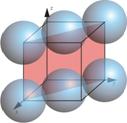 |
$$4\frac{1}{4}+2\frac{1}{2}=2$$ | $$\sqrt{2}a^{2}$$ | $$\frac{2}{\sqrt{2}a^{2}}\simeq \frac{1.41}{a^{2}}$$ |
| $$\left \{ 111 \right \}$$ | 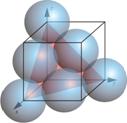 |
\(3\frac{1}{6}+3\frac{1}{2}=2\) | $$\frac{\sqrt{3}}{2}a^{2}$$ | $$\frac{4}{\sqrt{3}a^{2}}\simeq \frac{2.30}{a^{2}}$$ |
A diferencia de la estructura CCI, en la CCC ambos tipos de intersticios tienen formas regulares.
Ubicación de los intersticios en la estructura CCC. (Para mayor claridad, los átomos de los centros de cada cara se ha dibujado en otro color).
Enlace para ver a pantalla completa
– Los intersticios tetraédricos se sitúan en los centros de los ocho cubitos en que se puede dividir el cubo elemental, o sea, en la posición \(\left ( \frac{1}{4},\frac{1}{4},\frac{1}{4} \right )\) y equivalentes. Hay un total de 8 intersticios tetraédricos por celdilla y cada uno puede albergar un átomo extraño de radio máximo igual a 0.225 r. Así pues, para la estructura CCC, a diferencia de la CCI, los intersticios mayores son los octaédricos y no los tetraédricos.
Ubicación de los intersticios en la estructura CCC. (Para mayor claridad, los átomos de los centros de cada cara se ha dibujado en otro color).
Enlace para ver a pantalla completa
– Los intersticios octaédricos se encuentran en el centro del cubo y en el punto medio de cada una de las aristas de la celdilla. Hay un total de 4 intersticios octaédricos por celdilla: 1 · 1 (en el centro del cubo) + \(\frac{1}{4}12\) (en mitad de las aristas. El radio máximo de un átomo que pudiera alojarse en el interior de estos intersticios vale 0.414 r.