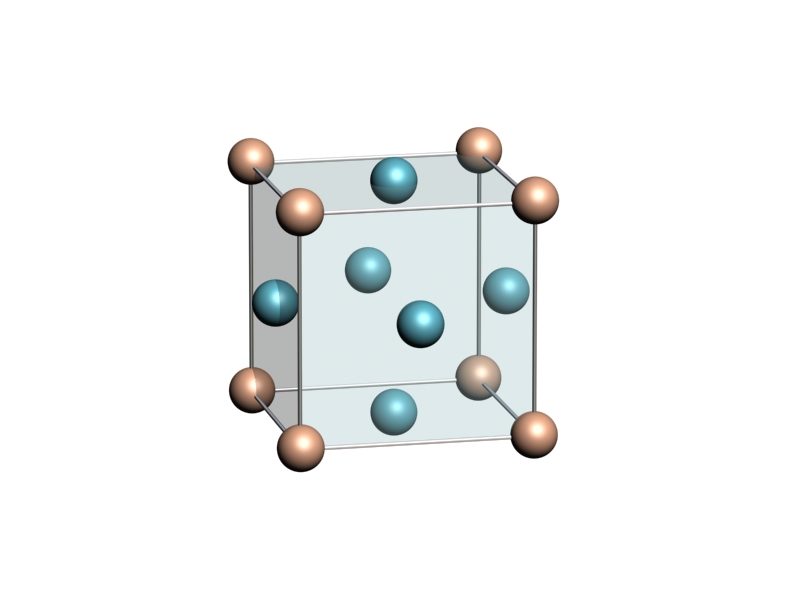
La mayoría de los elementos metálicos cristaliza siguiendo únicamente tres tipos de estructuras:
En la bibliografía inglesa, los acrónimos empleados (escritos indistintamente en mayúsculas o minúsculas) son BCC, de Body-Centered Cubic, FCC, de Face-Centered Cubic y HCP, de Hexagonal Close-Packed.
| CCI | CCC | HC |
 |
 |
 |
| Para mayor claridad, los átomos que no se encuentran en los vértices de las celdillas cúbicas, y los que están en el plano intermedio de la hexagonal, se han dibujado en otro color. | ||
Por ejemplo, el cromo, el molibdeno, el wolframio, el vanadio o el tántalo adoptan una estructura de tipo CCI. Otros muchos metales, como el níquel, la plata, el cobre, el platino, el aluminio o el plomo, adoptan una estructura CCC. Y otros muchos cristalizan siguiendo el patrón HC, como el magnesio, el cobalto, el zinc, el cadmio o el berilio.
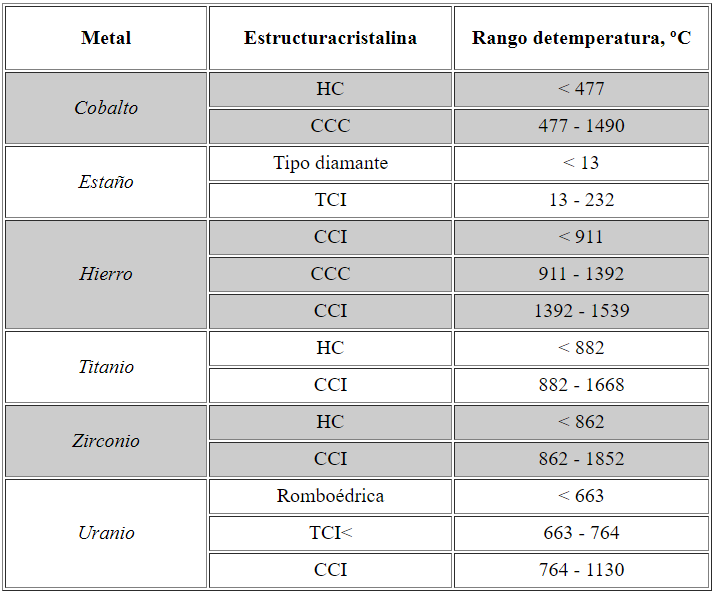
Además, dependiendo de la presión y de la temperatura, un mismo elemento puede adoptar más de una estructura cristalina. Por ejemplo, el hierro puro tiene estructura CCI a temperatura ambiente, cambia a CCC a 911 ºC, y vuelve a cambiar a CCI a la temperatura de 1392 ºC. La posibilidad de adopción de diferentes formas cristalinas es un fenómeno que, genéricamente, se denomina polimorfismo (alotropía, si se trata de un elemento puro).
La razón por la que cierto metal sigue un determinado patrón de cristalización y no otro, obedece, en última instancia, a consideraciones energéticas. La estabilidad de una estructura cristalina se mide a través de su energía libre (G=H-TS), de modo que la forma alotrópica más estable, para una temperatura y presión determinadas, es aquélla que tiene menor energía libre. Las estructuras HC y CCC, debido a su mejor aprovechamiento del espacio, poseen entalpía y entropía más bajas que las correspondientes de la estructura CCI.
Diferentes formas alotrópicas de algunos elementos metálicos, y su correspondiente rango de temperaturas.