Carácter iónico \(\frac{r_{Zn^{+}}}{r_{S^{-}}}=\frac{0.067}{0.168}= 0.4 \Rightarrow\) Coord. Tetraédrica
| A) Variedad Esfalerita |  |
| Estructura cristalina | Red: CCC |
| Base: Aniones en posiciones N | Cationes en N + (\(\frac{1}{4},\frac{1}{4},\frac{1}{4}\)) |

Número de iones/celdilla 4 S2- 4 Zn2+
Contacto entre cada Zn 2+ y los S2- que lo rodean
$$\frac{\sqrt{3}}{4}a=(r_{+}+r_{-})\Rightarrow a=\frac{4}{\sqrt{3}}(r_{+}+r_{-})$$
 |
 |
 |
Otros compuestos cristalizan según esta misma estructura.
- Semiconductores como el GaAs, InP, CdTe,…
- Carburos, como el beta-SiC
- Nitruros, como el BN
La componente covalente en algunos de ellos es bastante importante. En estos casos la estructura es la misma debido a la hibridación sp3 formada.
| B) Variedad Wurzita | 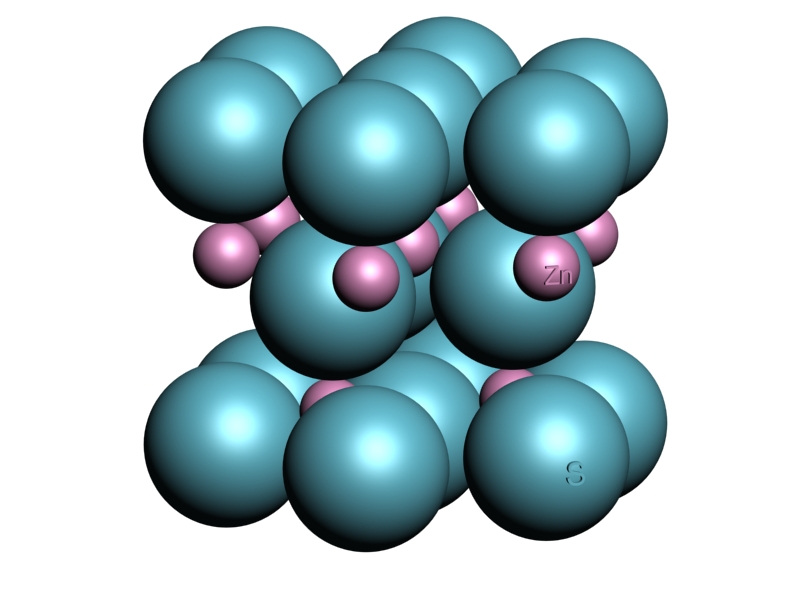 |
| Estructura cristalina | Red: HC |
| Base (4 Iones): | |
|
2 Aniones S2 2 Cationes Zn2+ |
Cationes en N y N + (\(\frac{2}{3},\frac{1}{3},\frac{1}{2}\)) Cationes en N + (\(\frac{2}{3},\frac{1}{3},\frac{1}{6}\)) y N + (\(0,0,\frac{2}{3}\)) |
No se han representado los casquetes esféricos de los átomos de celdillas adyacentes que en realidad estarían dentro del prisma hexagonal de la celdilla considerada.

|
Puede describirse más claramente como: Los S2- ocupan las posiciones de la HC Los Zn2+ se sitúan en la mitad de los I.T. |
  |
Número de iones/celdilla 6 S2- 6 Zn2+
Contacto entre cada Zn2+ y los S2- que lo rodean